Graphite, molecular formula: C, molecular weight: 12.01, ay isang anyo ng elementong carbon, ang bawat carbon atom ay konektado ng tatlong iba pang carbon atoms (nakaayos sa honeycomb hexagons) upang bumuo ng isang covalent molecule.Dahil ang bawat carbon atom ay naglalabas ng isang electron, ang mga maaaring malayang gumalaw, kaya ang grapayt ay isang konduktor.
Ang graphite ay isa sa pinakamalambot na mineral, at kasama sa paggamit nito ang paggawa ng mga lead ng lapis at pampadulas.Ang carbon ay isang non-metallic na elemento na matatagpuan sa pangalawang cycle IVA group ng periodic table.Ang graphite ay nabuo sa mataas na temperatura.
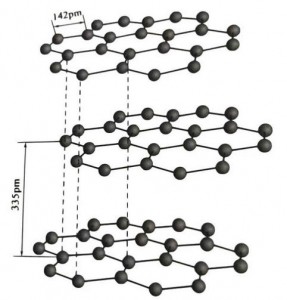
Ang graphite ay isang mala-kristal na mineral ng mga elemento ng carbon, at ang mala-kristal na sala-sala nito ay isang hexagonal na layered na istraktura.Ang distansya sa pagitan ng bawat mesh layer ay 3.35A, at ang spacing ng carbon atoms sa parehong mesh layer ay 1.42A.Ito ay isang hexagonal crystal system na may kumpletong layered cleavage.Ang ibabaw ng cleavage ay pangunahing mga molecular bond, hindi gaanong kaakit-akit sa mga molekula, kaya ang natural na float nito ay napakaganda.
Sa mga graphite na kristal, ang mga carbon atom sa parehong layer ay bumubuo ng isang covalent bond na may sp2 hybridization, at ang bawat carbon atom ay konektado sa tatlong iba pang mga atom sa tatlong covalent bond.Ang anim na carbon atom ay bumubuo ng anim na tuluy-tuloy na singsing sa parehong eroplano, na umaabot sa isang lamella na istraktura, kung saan ang haba ng bond ng CC bond ay 142pm, na eksaktong nasa loob ng hanay ng haba ng bono ng atomic crystal, kaya para sa parehong layer , ito ay isang atomic na kristal.Ang mga carbon atom sa parehong eroplano ay may isang p orbit, na nagsasapawan sa isa't isa.Ang mga electron ay medyo libre, katumbas ng mga libreng electron sa mga metal, kaya ang grapayt ay maaaring magsagawa ng init at kuryente, na siyang katangian ng mga metal na kristal.Kaya inuri din bilang mga metal na kristal.
Ang gitnang layer ng graphite crystal ay pinaghihiwalay ng 335pm, at ang distansya ay malaki.Ito ay pinagsama sa puwersa ng van der Waals, iyon ay, ang layer ay kabilang sa molekular na kristal.Gayunpaman, dahil ang pagbubuklod ng mga carbon atom sa parehong layer ng eroplano ay napakalakas at napakahirap sirain, ang dissolution point ng graphite ay napakataas din at ang mga kemikal na katangian nito ay matatag.
Sa view ng kanyang espesyal na bonding mode, ay hindi maaaring isaalang-alang bilang isang solong kristal o polycrystal, grapayt ngayon ay karaniwang itinuturing bilang isang halo-halong kristal.
Oras ng post: Hul-31-2023